2.2.2 Le modèle de Bohr; l'atome d'hydrogène
Nous vous présentons ici les résultats des recherches de Bohr. Lisez d'abord le texte de ce paragraphe, et lisez ensuite la section 5.2 de votre manuel de référence. Vous terminerez avec les exercices 14, 15 et 16 du chapitre 5. Tout comme à la section 2.2.1, nous vous suggérons de répondre aux questions suivantes en même temps que vous effectuerez vos lectures. Nous pourrons alors suivre votre démarche d'apprentissage et ce sera pour vous une façon d'amorcer votre étude.
Décrivez succinctement le modèle de Bohr proposé pour l'atome d'hydrogène et représentez-le par un schéma.
Que veut-on dire lorsqu'on affirme que l'énergie de l'électron est quantifiée ?
Quelle est l'équation mathématique qui exprime la quantification de l'énergie ? (voir
p. 143 du manuel.)
N.B. Vous devez inscrire vos formules mathématiques et faire vos schémas dans votre cahier de notes de cours format papier.
Bohr (1911) Modèle atomique de l'atome d'hydrogène
Modèle
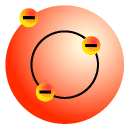
Le modèle de l'atome d'hydrogène de Bohr suppose que...
- L'électron se déplace autour du noyau selon une orbite circulaire.
Chacune des orbites, selon sa distance par rapport au noyau, est associée à une énergie spécifique. L'énergie associée au mouvement de l'électron selon une orbite permise a donc une valeur fixe, une valeur quantifiée.
On dit donc que l'énergie de l'électron est quantifiée. Pour comprendre ce que cela signifie, regardons la figure suivante.
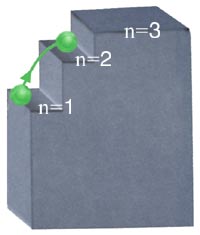
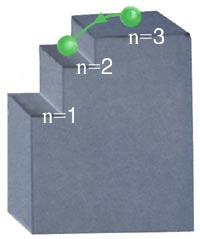
Le palier de l'escalier représente la position du noyau; chacune des marches de l'escalier représente une orbite permise. L'électron qui monte l'escalier peut demeurer à la première marche. Il peut aussi bondir de la première marche à la deuxième ou encore à la troisième ou à la quatrième... L'électron doit donc absorber de l'énergie pour monter une marche. Il ne peut cependant s'arrêter entre deux marches. C'est le même principe quand l'électron descend l'escalier sauf que, cette fois-ci, pour descendre une marche, il doit libérer de l'énergie.
Vous comprenez maintenant ce qu'est la quantification de l'énergie!
Tant que l'électron circule sur une même orbite, il ne perd ni ne gagne de l'énergie. Il est dans un état stationnaire d'énergie.
L'énergie de l'électron à un niveau d'énergie donné peut se calculer avec l'équation mathématique suivante : l'équation de Bohr.
En = - B (1/n2)
Où B est une constante et est égal à 2,18 x 10-18 J (joules).
Et n est le nombre quantique principal et prend comme valeur un nombre entier positif : 1, 2 ...
Lorsque l'électron circule selon l'orbite permise qui est la plus rapprochée du noyau, le nombre quantique principal prend alors la valeur de 1 (n=1). L'électron est ainsi au niveau d'énergie le plus bas et l'atome est dans son état le plus stable. Dans l'atome d'hydrogène, si l'électron occupe un niveau d'énergie supérieur à 1 (n = 2, 3, 4 ...), on dit qu'il occupe un niveau d'énergie excité. L'électron est alors dans un état excité.
Pourquoi l'énergie de l'électron a-t-elle une valeur négative ?
C'est tout simplement une convention car on sait, selon la physique, que tout corps tend vers l'énergie minimale. Lorsque n = infini, l'électron est libre; il ne fait plus partie de l'atome (En = 0). Le signe négatif signifie donc que l'énergie de l'électron dans l'atome est inférieure à celle d'un électron libre. Quand l'électron s'approche du noyau, n diminue et son énergie (En) devient de plus en plus négative. À n = 1, En est la plus basse, car c'est à ce niveau que l'électron est le plus stable.
Lorsque l'électron passe d'un niveau d'énergie à un autre (d'une orbite à une autre), il émet ou absorbe de l'énergie sous forme de lumière. Il fait alors un saut quantique. Lorsque par exemple n passe de 1 à 2, il y a absorption d'énergie; lorsque n passe de 4 à 2, il y a émission d'énergie.
La différence d'énergie entre les deux niveaux peut alors être calculée avec l'équation suivante.
DE = Enf - Eni = B (1/ni2 - 1/nf2)
Où Enf et Eni sont respectivement l'énergie de l'électron à son état final et l'énergie de l'électron à son état initial. Allez voir à la
page 159 de votre manuel de référence l'exemple de l'électron de l'atome d'hydrogène qui passe du niveau d'énergie n = 4 à n = 1 .
Comme la lumière est caractérisée par un flux de photons, ses sauts quantiques se traduisent par l'absorption ou l'émission de photons. On peut aussi calculer la différence d'énergie avec l'équation de Planck.
DE = hc/l = hn
Où :
- h est la constante de Planck et est égal à 6,626 x 10-34 J.s;
- c est la vitesse de la lumière = 3,00 ´ 108 m/s;
- l est la longueur d'onde en nm du photon émis ou absorbé;
- n est la fréquence de la lumière émise ou absorbée en s-1.
Il ne faut pas oublier que l'énergie de l'électron est quantifiée. Donc, seuls les photons possédant une énergie égale à la différence d'énergie entre deux niveaux peuvent être absorbés.
On peut finalement écrire : DE = Enf - Eni = B (1/ni2 - 1/nf2) = hc/l = hn.
Si DE > 0, l'électron a absorbé de l'énergie. Il a passé d'un niveau d'énergie inférieur à un niveau supérieur.
Si DE < 0, l'électron a émis de l'énergie. Il a passé d'un niveau d'énergie supérieur à un niveau inférieur.
Allez voir l'exemple 5.3 de la
page 147 de votre manuel de chimie générale.
L'animation suivante illustre le processus d'émission de l'énergie sous forme de lumière visible dans un atome d'hydrogène.
On remarque que chaque émission de photons correspond à une longueur d'onde bien précise. En effet, comme nous l'avons vu précédemment: DE = hc/l, où DE est la différence d'énergie entre deux niveaux et l est la longueur d'onde de la radiation émise. Chaque atome aura donc un spectre caractéristique de différentes longueurs d'onde bien spécifiques qui correspondent à des couleurs dans le visible ou encore dans l'infrarouge ou dans l'ultraviolet...
Comparez cette animation avec la figure 5.9 se trouvant à la
page 149 de votre manuel de référence. L'animation présente la série des transitions électroniques pour l'atome d'hydrogène nommée « la série de Balmer », série qui se trouve à droite dans la figure 5.9 du manuel. Le niveau d'arrivée des électrons est n = 2 et les longueurs d'onde émises sont dans le visible. Cependant, l'hydrogène émet aussi de l'énergie dans l'ultraviolet et dans l'infrarouge. Ces deux séries de transition uv (ultraviolet) et ir (infrarouge) n'apparaissent que dans la figure 5.9, à gauche.