Protocole du Laboratoire 2
Attention, vous devez imprimer ce protocole ainsi que votre document sur la sécurité et les apporter au laboratoire.
Introduction : La sécurité au laboratoire (0,5 heure)
Parlons sécurité en remplissant ensemble le questionnaire sur la sécurité au laboratoire.
Première partie : Masse volumique (1,5 heure)
DÉTERMINATION DE LA MASSE VOLUMIQUE D'UN LIQUIDE
But
Déterminer la masse volumique (densité absolue ou r) d'une solution de chlorure de sodium.
Définitions
- Masse volumique ou densité absolue
La masse volumique d'une substance est la masse d'une substance par unité de volume à une température donnée. Elle peut se définir par la relation suivante.
masse volumique = r = densité absolue = dT = masse de substance = m 
volume de substance V La masse volumique d'une substance (r) est donc un synonyme de la densité absolue (dT) de la substance.
m = masse de la substance en grammes
V = volume de la substance en cm3 ou en mL pour un liquide ou un solide
- Densité relative ou densité
La densité relative (ou densité) d'une substance à l'état solide ou liquide est le rapport entre la masse volumique de la substance à une température T et la masse volumique de la substance de référence, soit l'eau à 3,98°C (donc environ 4°C).
La densité relative d'une substance (solide ou liquide) peut donc s'exprimer de la façon suivante.
d T 3,98 = dT (substance) 
d3,98 (eau) La masse volumique de l'eau à 3,98°C = 0,999973 g/cm3.
Vous trouverez la densité relative d'une substance exprimée selon l'une ou l'autre des façons suivantes.
d T 3,98 @ d T 4 D'une autre manière, on pourrait dire que la densité relative (ou densité) pour un solide ou un liquide est la masse d'un certain volume de substance par rapport à la masse d'un même volume d'eau à 3,98°C (donc environ 4°C).
Si, par exemple, une substance a une densité de 1,5, cela signifie que sa masse volumique est 1,5 fois plus élevée que la masse volumique de l'eau à 4°C.
Matériel nécessaire
Une balance analytique
Un pèse-tare
Un compte-gouttes
Un thermomètre gradué de 0-100°C
NaCl (Masse molaire = 58,44 g/mol)
Un bécher de 100 mL
Un ballon jaugé de 250,0 mL (incertitude ± 0,1 mL)
Un ballon jaugé de 100,00 mL (incertitude ± 0,08 mL)
Une pipette jaugée de 10,00 mL (incertitude ± 0,02 mL)
Manipulations
A) Préparation des solutions
Référez-vous à la capsule vidéo Préparation des solutions.
Dans cette partie du laboratoire, vous préparerez deux solutions de chlorure de sodium. La première, la solution A, est la solution mère à partir de laquelle vous préparerez par dilution une solution diluée B.
Préparer avec précision 250,0 mL d'une solution aqueuse de NaCl "A" environ 5 % m/V (5 g de NaCl pour 100 mL de solution).
Peser dans un bécher de 100 mL exactement environ 12,5 g de NaCl en utilisant la balance analytique. Noter la masse.
Ajouter 50 mL d'eau déionisée dans le bécher contenant le NaCl.
Dissoudre le NaCl en agitant la solution à l'aide d'une tige de verre.
À l'aide d'un entonnoir, transférer cette solution dans le ballon jaugé de 250 mL. Rincer trois fois le bécher avec des portions de 25 mL d'eau déionisée et transférer dans le ballon jaugé.
Bien agiter la solution en bouchant le ballon jaugé.
Compléter jusqu'au trait de jauge avec de l'eau déionisée. Agiter de nouveau.
Préparer 100 mL d'une solution de chlorure de sodium 1% m/V.
Solution B : 20,00 mL de solution A + eau déionisée jusqu'à 100 mL
Utiliser une pipette jaugée de 10,00 mL ainsi qu'un ballon jaugé de 100,0 mL.
B) Détermination de la masse volumique de la solution B de chlorure de sodium
À l'aide d'une balance analytique, peser un pèse-tare propre et sec (avec son bouchon).
Pipeter 10,00 mL de la solution B et transférer dans le pèse-tare.
Peser le pèse-tare rempli de la solution de chlorure de sodium.
Noter la température de la solution.
Tableaux des mesures
N'oubliez pas d'indiquer les incertitudes.
A) Prépation des solutions de chlorure de sodium
Masse du chlorure de sodium : ___________ g
B) Masse volumique de la solution B
| Masse du pèse-tare vide | |
| Masse du pèse-tare rempli de la solution de NaCl | |
| Volume mesuré de la solution B | |
| Température de la solution |
Deuxième partie : Dosage volumétrique (2 heures)
DÉTERMINATION DU SEL DANS LA SOUPE
Cette deuxième partie du laboratoire 2 provient des professeurs du département de chimie du collège François-Xavier-Garneau.
Problématique
Les soupes sont-elles trop salées ?
Stratégie
Pour déterminer le sel dans la soupe, on utilise le titrage par précipitation. On présume que tout le chlorure est sous forme de chlorure de sodium, NaCl.
Théorie
La quantité de sodium, Na+, absorbée quotidiennement présente un intérêt d'ordre médical : une trop grande quantité peut être dommageable pour la santé. La consommation nécessaire en sodium, Na+, pour un individu de taille moyenne est d'environ 500 mg par jour, soit plus précisément 9 mg/kg de poids corporel. Une grande part de ce sodium est ingérée sous forme de sel de table, NaCl.
Il s'agit de déterminer le nombre de moles d'une espèce en la faisant précipiter à l'aide d'un volume connu d'une solution étalon. La fin du titrage est indiquée par l'action d'un indicateur. Ce dernier forme, avec la substance étalon, un précipité de coloration différente et de solubilité supérieure à celle du premier précipité. Dans le dosage du sel dans la soupe, on utilise comme substance étalon du nitrate d'argent, AgNO3, qui réagit avec l'ion chlorure, Cl-, de la soupe. Le produit de cette réaction est du chlorure d'argent, AgCl, précipité blanc.
NaCl + AgNO3 ![]() AgCl + NaNO3
AgCl + NaNO3
Lorsqu'il ne reste plus de chlorure, Cl-, en solution, le nitrate d'argent réagit avec l'indicateur, le chromate de potassium, K2CrO4, pour former un précipité rouge, Ag2CrO4, ce qui indique la fin du titrage.
2 AgNO3 + K2CrO4 ![]() Ag2CrO4 + 2 KNO3
Ag2CrO4 + 2 KNO3
Au point de virage, tout le Cl- a réagi et il apparaît alors une coloration rouge, Ag2CrO4, qui indique l'arrêt du titrage.
Pour les calculs stœchiométriques, le nombre de moles de nitrate d'argent correspond au nombre de moles de chlorure de sodium.
Matériel nécessaire
Une pipette jaugée de 10,00 mL
Une poire à pipette
Un erlenmeyer de 125 mL
Un barreau aimanté
Une plaque agitatrice
Une burette de 50,0 mL
Un cylindre gradué de 10,0 mL
Un bécher de 1000 mL
Une solution de nitrate d'argent AgNO3 0,1 M (mol/L de solution)
Une solution de chromate de potassium K2CrO4 0,1 M ( mol/L de solution)
Manipulations
Les techniciens préparent les soupes selon les indications du fabricant.
Noter la marque de la soupe qui est assignée pour l'analyse.
Mesurer 10,00 mL de soupe à l'aide d'une pipette jaugée et verser le contenu dans un erlenmeyer de 125 mL. Éviter autant que possible les matières solides.
À l'aide d'un cylindre gradué, ajouter 20 mL d'eau déionisée.
À l'aide d'un cylindre gradué, introduire 10 mL d'une solution de chromate de potassium, K2CrO4 (indicateur).
Effectuer le titrage.
- Faire le montage tel qu'il est présenté sur les photos.

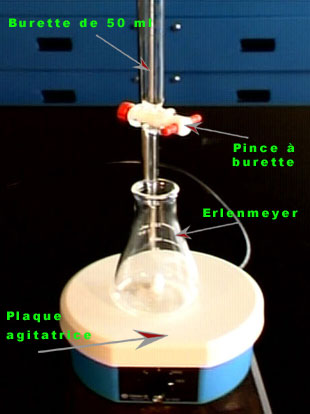
- Conditionner la burette avec de l'eau puis avec un petit volume de la solution de nitrate d'argent, AgNO3, qui est le titrant de concentration précise et connue.
- Titrer jusqu'à l'apparition d'une couleur orangée, résultant de la combinaison de la couleur jaune de la soupe et de la couleur rouge du Ag2CrO4.
- Vider le contenu de l'erlenmeyer dans un bécher de récupération de 1000 mL. Rincer ensuite l'erlenmeyer plusieurs fois avec de l'eau déionisée.
- Faire le montage tel qu'il est présenté sur les photos.
Répéter les étapes 2 à 5 jusqu'à ce que les volumes de titrant aient un écart maximal de ± 0,2 mL.
Écrire les lectures dans le tableau des mesures, c'est-à-dire la MARQUE DE SOUPE et les 3 VOLUMES de titrant utilisés pour la soupe.
Mesures
Concentration de la solution de nitrate d'argent : _________________
Tableau des mesures
| Marque de soupe | Volume de titrant essai 1 |
Volume de titrant essai 2 |
Volume de titrant essai 3 |
|---|---|---|---|
Volume moyen = ____________________
Comme incertitude du volume moyen, prenez le même nombre que vous avez utilisé pour les autres valeurs de volume mesurées à la burette.