Distillation fractionnée et caractérisation physico-chimique des liquides (Protocole de l'expérience: 4 heures)
Buts
Séparer par distillation deux liquides inconnus et mesurer quelques propriétés physico-chimiques de ces liquides, soit :
la température d'ébullition,
l'indice de réfraction,
la masse volumique,
la viscosité.
Identifier vos deux liquides inconnus en comparant les propriétés mesurées aux valeurs publiées dans les ouvrages de référence tel que Handbook of Chemistry and Physics.
A) Distillation fractionnée et température d'ébullition
Principe
La distillation fractionnée consiste à faire plusieurs vaporisations et condensations successives à l'intérieur d'une colonne à fractionnement de type vigreux. À chaque étape, la vapeur qui monte dans la colonne s'enrichit de plus en plus de la substance la plus volatile.
La colonne vigreux sert à séparer un mélange de liquides ayant des températures d'ébullition différentes.
Visionnez la capsule vidéo.
Matériel et produits
Verrerie à joints rodés pour distillation
Colonne vigreux
Mélange de deux liquides inconnus choisis parmi les suivants : acétone, pentane, butanol-2, cyclohexane, heptane, eau, méthanol
Montage

Légende
Rhéostat
Calotte chauffante
Pierre à ébullition
Ballon à fond rond
Colonne à distillation de type Vigreux
Pics de verre
Adaptateur
Adaptateur
Thermomètre
Réfrigérant
Cylindre gradué
Mode opératoire
Faire le montage tel qu'il est montré sur le schéma précédent.
Verser le mélange inconnu dans le ballon bouilloire et ajouter deux ou trois grains de porcelaine poreuse. Les morceaux de porcelaine empêchent la formation d'un trop grand bouillonnement à l'intérieur du ballon.
À l'aide du transformateur à voltage variable (rhéostat), régler le chauffage de la calotte chauffante de façon à ce que le distillat s'écoule à la vitesse d'environ une goutte par seconde.
Maintenir le chauffage pendant le passage du liquide inconnu I.
Recueillir le liquide dans un cylindre gradué de 10 mL propre et sec.
Noter la température d'ébullition à tous les 2 mL; noter également la pression atmosphérique; consigner les résultats dans le tableau.
La température d'ébullition devrait rester constante durant toute la première partie de cette distillation.
Lorsque le cylindre de 10 mL est plein, continuer à recueillir ce liquide à l'aide d'un 2e cylindre gradué de 10 mL propre et sec.
Verser le 1er 10 mL de liquide I dans la bouteille qui contenait votre mélange inconnu.
Continuer à observer la température à laquelle s'effectue la distillation.
Lorsque le premier inconnu aura été entièrement distillé, on devrait observer un arrêt de la distillation et un abaissement de la température dans la colonne, car le 2e inconnu ayant une température d'ébullition plus élevée, il sera nécessaire d'augmenter le taux de chauffage fourni par le transformateur afin d'obtenir à nouveau une vitesse d'écoulement d'une goutte par seconde.
Continuer à recueillir la 2e fraction à la suite de la première.
Arrêter la distillation lorsqu'il ne restera plus qu'environ 1 mL dans le ballon bouilloire.
À la fin de l'expérience, sécher le montage. Ne pas rincer avec de l'eau.
Pour la 2e partie de l'expérience, on vous fournira des échantillons purs de vos deux liquides inconnnus.
B) Indice de réfraction
Principe
L'indice de réfraction d'un liquide pur est une caractéristique de celui-ci qui est facilement mesurable par des méthodes optiques.
Quand un faisceau lumineux arrive à la surface d'un liquide avec un angle d'incidence "i" à l'intérieur du liquide, cet angle devient plus petit « r », à cause de la réfraction causée par le liquide.
N'oubliez pas de faire l'exercice avec le didacticiel.
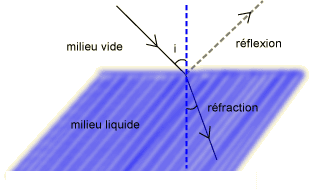
L'indice de réfraction est défini par la loi de SNELL :
| n = | = |
L'indice de réfraction pour un liquide dépend de la température et varie avec la longueur d'onde de la lumière incidente.
Correction pour la température
Les valeurs de référence des indices de réfration des liquides sont données dans les Handbook à une température de 20°C. Pour les composés organiques, on a trouvé que, lorsque la température augmente de 1°C, l'indice de réfraction diminue de 0,0004.
Exemple : si à 22°C, l'indice de réfraction est 1,3603, alors à 20°C l'indice de réfraction sera de 1,3611.
Vous devrez donc noter la température à laquelle vous avez mesuré l'indice de réfraction pour faire la correction plus tard.
Matériel
- Réfractomètre ABBE ATAGO modèle 302
- Deux liquides inconnus séparés par distillation
- Deux compte-gouttes propres et secs
Mode opératoire
Mesurer l'indice de réfraction de chacun des deux liquides inconnus en suivant bien les instructions données dans le cahier de laboratoire (pages X-6 et X-7).
Noter pour chacun l'indice de réfraction et la température du thermomètre attaché au réfractomètre.
Réfractomètre Abbe

Légende
Oculaire
Source lumineuse pour le spécimen
Vis d'ouverture du prisme
Prisme collatéral
Prisme principal sur lequel on dépose le liquide à étudier
Thermomètre utilisé pour indiquer la température autour du spécimen
Selon la lecture faite sur le thermomètre, une correction de lecture pourra être nécessaire.
Transformateur, l'intensité lumineuse pouvant être ajustée à 2 positions (Hi – Lo)
Roulette d'ajustement
Roulette d'ajustement
Utilisation du réfractomètre Abbe (Atago modèle 302)
Placer l'appareil avec la poignée devant soi.
Brancher le transformateur (7) à la prise de courant.
Appuyer sur le bouton « On » du transformateur (7) — sur le modèle illustré, il est situé à l'arrière — et sur le bouton « High ».
Ouvrir les prismes avec la vis (3), les nettoyer avec le méthanol et un tissu doux (papier mouchoir), puis les sécher.
Placer quelques gouttes (3 à 5) d'un de vos liquides sur le prisme principal (5) à l'aide d'un compte-gouttes (sans toucher au prisme) et fermer les prismes avec la vis (3). Voir le schéma de l'appareil.
Avec la roulette d'ajustement (9), déplacer l'échelle graduée — que l'on voit dans l'oculaire — aux alentours de la valeur attendue. À ce moment, on voit apparaître les couleurs de l'arc-en-ciel dans le carré au-dessus de l'échelle.
Avec la roulette d'ajustement (8), faire un ajustement fin jusqu'à ce que la démarcation entre l'ombre et la clarté soit nette. Finir cet ajustement avec l'oculaire (1).
Avec la roulette d'ajustement (9), ajuster cette ligne horizontale au centre de la croix.
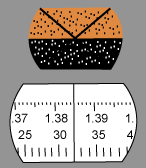
Prendre la lecture. La quatrième décimale sera approximative; la lecture serait ici 1,3848.
Noter la température.
Ouvrir les prismes, les nettoyer avec le méthanol et les essuyer avec un tissu doux.
Fermer les prismes.
Effectuer cette mesure assez rapidement si le liquide est volatil.
C) Mesure de la masse volumique
Principe
La masse volumique (ou densité absolue) est la masse d'une substance liquide ou solide contenue dans 1 cm3 (ou 1 mL).
| d = |
dT : masse volumique à la température T (en g/cm3)
m : masse de la substance (en g)
V : volume (en cm3)
Matériel
Balance analytique (utiliser toujours la même)
Pèse-tare
Deux liquides inconnus séparés par distillation
Thermomètre
Mode opératoire
À l'aide d'une balance analytique, peser un pèse-tare propre et sec (avec son bouchon).
Pipeter 5,00 mL de la solution inconnu 1 et le transférer dans le pèse-tare.
Peser le pèse-tare rempli de votre liquide inconnu 1.
Noter la température de votre liquide.
Répéter ces quatre opérations avec le liquide inconnu 2.
D) Mesure de la viscosité
PRINCIPE
Globalement, on peut définir la viscosité d'un fluide (gaz ou liquide) comme étant la résistance à l'écoulement.
Dans le cas relativement simple de l'écoulement d'un liquide dans un tube capillaire, la loi de Poiseuille (1884) montre que la viscosité « h » (êta) pour un liquide donné est directement proportionnelle à sa densité D et au temps d'écoulement t.
où A est la constante caractéristique du viscosimètre employé.
L'unité de viscosité est la poise (p).
1 poise = 1 g×cm-1×sec-1
Généralement, pour les liquides, la viscosité s'exprime en centipoises (cp), c'est-à-dire en centième de poise.
Le viscosimètre permettant d'exploiter correctement la relation ci-haut est dû à Ostwald. Le viscosimètre de Ostwald est représenté sur la figure ci-dessous.
Viscosimètre d'Ostwald

À l'aide d'une poire à pipette, on fait monter le liquide au-dessus du trait de référence « A ».
Le temps d'écoulement « t » est celui mesuré entre les deux traits « A » et « B ».
Si, à l'aide d'un même viscosimètre, on effectue des mesures pour deux liquides différents 1 et 2, on peut écrire la relation suivante :
| = |
Matériel
Viscosimètre d'Ostwald
Poire à pipette
Chronomètre
Pipette de 5 mL
Liquide de référence : eau déionisée
Liquide inconnu I, liquide inconnu II
Mode opératoire
Rincer le viscosimètre à l'acétone et le sécher à l'air comprimé avant de le remplir du liquide à étudier.
Il faut que le volume du liquide à étudier soit constant (5 mL) pour s'assurer d'une pression hydrostatique constante.
Par succion à l'aide d'une poire à pipette, faire monter le liquide au-dessus du trait de référence supérieur « A ».
À l'aide d'un chronomètre, mesurer le temps d'écoulement du liquide entre les deux traits de référence gravés sur le viscosimètre.
Répéter les mesures jusqu'à l'obtention de trois valeurs constantes à 0,5 seconde près pour un même liquide.
Cette manipulation doit être effectuée pour l'eau et pour les deux liquides inconnus.
Résultats expérimentaux
A) Distillation fractionnée et température d'ébullition
| Volume de liquide (mL) |
Température (°C) |
Volume de liquide (mL) |
Température (°C) |
|---|---|---|---|
| 2 | 36 | ||
| 4 | 38 | ||
| 6 | 40 | ||
| 8 | 42 | ||
| 10 | 44 | ||
| 12 | 46 | ||
| 14 | 48 | ||
| 16 | 50 | ||
| 18 | 52 | ||
| 20 | 54 | ||
| 22 | 56 | ||
| 24 | 58 | ||
| 26 | 60 | ||
| 28 | 62 | ||
| 30 | 64 | ||
| 32 | 66 | ||
| 34 | 68 |
Numéro de l'inconnu : __________
Pression atmosphérique : __________
Volume de liquide inconnu I recueilli : __________
Volume de liquide inconnu II recueilli : __________
B) Indice de réfration
| Indice de réfraction mesuré (n) |
Température (°C) |
Indice de réfraction corrigé à 20°C (n20) |
|
|---|---|---|---|
| Inconnu I | |||
| Inconnu II |
C) Masse volumique
| Masse du pèse-tare vide | g |
| Masse du pèse-tare rempli du liquide I | g |
| Masse du liquide I | g |
| Masse du pycnomètre rempli du liquide II | g |
| Masse du liquide II | g |
| Masse volumique du liquide I à ___ °C | g×cm-3 |
| Masse volumique du liquide II à ___ °C | g×cm-3 |
D) Viscosité
| Temps (t en secondes) | Masse volumique (d en g/cm3) | Viscosité (h en centipoises*) | |
|---|---|---|---|
| Eau | |||
| Inconnu I | |||
| Inconnu II |
* Voir « Handbook of Chemistry and Physics ».
Température = °C
| = |
Synthèse des propriétés physico-chimiques des liquides à l'étude
Vous devez compiler dans ce tableau les valeurs de référence et les valeurs mesurées au laboratoire pour en faire une comparaison. Indiquez la température lorsqu'elle a une influence sur la propriété physico-chimique du liquide.
| Formule chimique | Température d'ébullition normale (à 760 mmHg) | nd Indice de réfraction à 20°C |
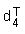 (Densité relative) |
h Viscosité(centipoise) |
|
|---|---|---|---|---|---|
| Pentane | C5H12 CH3(CH2)3CH3 |
||||
| Cyclohexane | C6H12 | ||||
| Heptane | C7H16 CH3(CH2)5CH3 |
||||
| Méthanol (methyl alcohol) |
CH3OH | ||||
| Butanol-2 (sec-butyl alcohol) |
C4H10O CH3CH2CHOHCH3 |
||||
| Acétone | C3H6O CH3COCH3 |
||||
| Eau | H2O | ||||
| Liquide I (valeurs mesurées au laboratoire) |
|||||
| Liquide II (valeurs mesurées au laboratoire) |
Référence : _________________________________________________
À l'aide de toutes ces données, on peut conclure que le mélange inconnu numéro ___________ contient du ______________________ et du ____________________.
Recherche des propriétés dans le Handbook of Chemistry and Physics
A) Les produits organiques (tous les produits du tableau précédent, sauf l'eau)
Vous devez chercher les valeurs et les propriétés dans la section Physical constants of organic compounds. Les produits sont classés dans l'ordre alphabétique.
Exemple :
Pentane
Température d'ébullition : b.p.°C (boiling point) = 36,1
Indice de réfraction : nD = 1,357520, c'est-à-dire 1,3575 à 20°C
Densité relative : Density = 0,626220/4, c'est-à-dire...
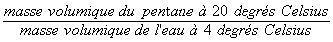
Viscosité : vous devez consulter l'Index of viscosity of liquids = 0,240 m.Pa.s (centipoise) à 20°C.
B) L'eau
Utiliser l'index du Handbook of Chemistry and Physics pour trouver les pages des tableaux fournissant les différentes propriétés.
- Boiling point of water
- Viscosity of water
- Index of refraction of water
- Density of water